СЕРЕБРО
СЕРЕБРО. Этот красивый металл известен людям с древнейших времен. Изделиям из серебра, найденным в Передней Азии, более 6 тысяч лет. Из сплава золота и серебра (электрума) были изготовлены первые в мире монеты. И в течение нескольких тысячелетий серебро, наряду с золотом и медью, было одним из основных монетных металлов. С цветом серебра связано и его латинское название Argentum, оно происходит от греческого argos – белый, блестящий.
Серебро в природе.
Серебро – редкий элемент; в земной коре его почти в тысячу раз меньше, чем меди – всего лишь около стотысячной доли процента. Известно же оно было так давно, потому что встречается в природе в виде самородков, иногда очень больших. Особенно богаты серебром были расположенные в Центральной Европе Рудные горы, Гарц, горы Богемии и Саксонии. Из серебра, добывавшегося близ города Иоахимсталя (ныне Яхимов в Чехии), были отчеканены миллионы монет. Они вначале так и назывались – «иоахимсталеры»; затем это название укоротилось до «талера» (в России эти монеты называли по первой части слова – «ефимками»). Талеры были в ходу по всей Европе, став самой распространенной большой серебряной монетой в истории. От талера произошло и название доллара. Немецкие серебряные рудники были настолько богаты, что из добывавшегося металла делали огромные вазы, столовые сервизы на сотни персон, на каждый из которых расходовали тонны серебра.
Легенда приписывает открытие серебряных рудников в 968 императору Оттону I Великому (912–973), основателю «Священной Римской империи германской нации». Во время учебы в Германии эту легенду услышал М.В.Ломоносов и изложил ее в одном из своих трудов. Оттон послал своего егеря Раммеля в лес для ловли диких зверей. На опушке леса Раммель спешился, а коня привязал к дереву. Ожидая хозяина, конь разрыл копытами землю и выбил оттуда тяжелые и светлые камни. Когда их показали императору, тот понял, что это богатая серебряная руда и велел учредить на этом месте рудники. А гору назвали Раммельсбергом. По свидетельству немецкого врача и металлурга Георга Агриколы (1494–1555) месторождение продолжало разрабатываться и при его жизни, то есть спустя шесть веков, но почти все серебряные самородки уже были найдены в 14–16 вв. Так, в 1477 в саксонском округе Цвиккау близ города Шнееберга был добыт самородок массой 20 тонн (современные геологи полагают, что он частично включал минерал аргентит). Серебряные рудники продолжали действовать ещё при жизни Ломоносова. Ныне они в значительной степени истощены.
После открытия и завоевания Америки множество самородков серебра было найдено на территории современных Перу, Чили, Мексики, Боливии. Так, в Чили был обнаружен самородок в виде пластины массой 1420 кг. Многие элементы имеют «географические» названия, Аргентина же – единственная страна, названная по уже известному элементу. Последние из самых крупных самородков серебра найдены уже в 20 в. в Канаде (провинция Онтарио). Один из них, названный «серебряный тротуар», имел длину 30 м и уходил вглубь земли на 18 м. Когда из него было выплавлено чистое серебро, его оказалось 20 тонн!
Самородное серебро находят редко; основная часть серебра в природе сосредоточена в минералах, которых известно более 50; в них серебро связано с серой, селеном, теллуром или галогенами. Основной серебряный минерал – аргентит Ag2S. Еще больше серебра рассеяно среди различных горных пород, так что основная часть добываемого в мире серебра получается в результате комплексной переработки полиметаллических руд, содержащих свинец, медь и цинк.
Свойства серебра.
Чистое серебро – сравнительно мягкий и пластичный металл: из 1 г серебра можно вытянуть тончайшую проволочку длиной почти 2 км! Серебро – довольно тяжелый металл: по плотности (10,5 г/см 3 ) оно лишь немного уступает свинцу. По электропроводности же и теплопроводности серебру нет равных (поэтому серебряная ложка в стакане горячего чая быстро нагревается). Плавится серебро при относительно низкой температуре (962° С), что значительно облегчает его обработку. Серебро легко сплавляется со многими металлами; небольшие добавки меди делают его более твердым, годным для изготовления различных изделий.
«Серебро не окисляется на воздухе, – писал Д.И.Менделеев в своем учебнике Основы химии, – а потому причисляется к разряду так называемых благородных металлов. Оно обладает белым цветом, гораздо более чистым, чем для всех других известных металлов, в особенности, когда оно представляет химическую чистоту. Химически чистое серебро столь мягко, что стирается весьма легко. » Но хотя серебро с кислородом непосредственно не реагирует, оно может растворять значительные количества этого газа. Даже твердое серебро при температуре 450° С способно поглотить пятикратный объем кислорода. Значительно больше кислорода (до 20 объемов на 1 объем серебра) растворяется в жидком металле.
Это свойство серебра приводит к красивому (и опасному) явлению – разбрызгиванию серебра, которое известно с древних времен. Если расплавленное серебро поглотило значительные количества кислорода, то затвердевание металла сопровождается высвобождением большого количества газа. Давлением выделяющегося кислорода корка на поверхности застывающего серебра разрывается, часто с большой силой. В результате происходит внезапное взрывное разбрызгивание металла.
При 170° С серебро на воздухе покрывается тонкой пленкой оксида Ag2О, а под действием озона образуются высшие оксиды Ag2O2 и Ag2O3. Но особенно «боится» серебро иода, например, иодной настойки и сероводорода. Во многих домах есть серебряные (или посеребренные) изделия – старые монеты, ложки, вилки, подстаканники, кольца, цепочки, другие украшения. Со временем они часто тускнеют и даже могут почернеть. Причина – действие сероводорода. Его источником могут быть не только тухлые яйца, но и резина, некоторые полимеры. В присутствии влаги серебро легко реагирует с сероводородом с образованием на поверхности тончайшей пленки сульфида: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O; из-за неровностей поверхности и игры света такая пленка иногда кажется радужной. Постепенно пленка утолщается, темнеет, становится коричневой, а потом черной. Сульфид серебра не разрушается при сильном нагреве, не растворяется в кислотах и щелочах. Не очень толстую пленку можно удалить механически, отполировав предмет зубной пастой или порошком с мыльной водой.
Чтобы защитить поверхность серебра от потемнения ее пассивируют – покрывают защитной пленкой. Для этого хорошо очищенное изделие погружают на 20 минут в слегка подкисленный 1%-ный раствор дихромата калия K2Cr2O7 при комнатной температуре. Образовавшаяся тонкая пленка Ag2Cr2O7 защищает поверхность серебра.
Серебро легко растворяется в азотной и горячей концентрированной серной кислоте: 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O; 2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O. Серебро растворяется также в концентрированных иодо- и бромоводородной кислотах, а в присутствии кислорода – и в хлороводородной (соляной) кислоте; реакции способствует образование комплексных галогенидов серебра: 2Ag + 4HI = 2H[AgI2] + H2
Применение серебра.
Старинное применение серебра – изготовление зеркал (сейчас недорогие зеркала покрывают алюминием). Из серебра делают электроды для мощных цинк-серебряных аккумуляторов. Так, в аккумуляторах затонувшей американской подводной лодки «Трешер» было три тонны серебра. Высокую теплопроводность и химическую инертность серебра используют в электротехнике: из серебра и его сплавов делают электрические контакты, серебром покрывают провода в ответственных приборах. Из серебряно-палладиевого сплава (75% Ag) делают зубные протезы.
Огромные количества серебра раньше шли на изготовление монет. Сейчас из серебра делают в основном юбилейные и памятные монеты. Самая тяжелая современная серебряная монета, выпущенная в России в 1999, весит 3000 граммов, имеет тираж 150 штук. Посвящена она 275-летию Санкт-петербургского монетного двора. При высоком содержании серебра монеты и другие изделия весьма устойчивы на воздухе. Низкопробное серебро часто зеленеет. Зеленый налет содержит основной карбонат меди (CuOH)2CO3. Он образуется под действием углекислого газа, паров воды и кислорода.
Много серебра расходуется для изготовления ювелирных изделий и столовых приборов. На таких изделиях, как правило, ставят пробу, указывающую массу чистого серебра в граммах в 1000 г сплава (современная проба), либо число золотнитков в одном фунте сплава (дореволюционная проба). В 1 фунте содержится 96 золотников, поэтому, например, старой пробе 84 соответствует современная (84/96)1000 = 875. Так, с 1886 проба монет достоинством 1 рубль, 50 и 25 копеек была 86 2/5 (современная 900), а проба 20-, 15-, 10- и 5-копеечных монет (они чеканились с 1867 года) была 48 (500). Советские рубли и полтинники имели пробу 900, а более мелкие – 500. Современные серебряные изделия могут иметь пробу 960, 925 (так называемое «стерлинговое» серебро), 916, 875, 800 и 750.
Чтобы узнать содержание серебра в сплаве (его пробу), а также отличить серебряные изделия от сплавов, похожих на серебро, используют разные способы. Самый простой – реакция с так называемой пробирной кислотой для серебра, которая представляет собой раствор 3 мл концентрированной серной кислоты и 3 г дихромата калия в 32 мл воды. Каплю раствора наносят на поверхность изделия в незаметном месте. Под действием серной кислоты в присутствии сильного окислителя медь и серебро переходят в сульфаты CuSO4 и Ag2SO4, далее сульфат серебра быстро превращается в нерастворимый рыхлый осадок дихромата серебра Ag2Cr2O7 красного цвета. Он особенно хорошо заметен на поверхности, если каплю осторожно смыть водой. Красный осадок легко удалить механически; при этом на поверхности останется чуть заметное светлое пятнышко.
Этот метод не дает положительного результата, если в сплаве меньше 25% серебра (т.е. проба меньше 250). Такие бедные серебром сплавы встречаются довольно редко. В этом случае серебро можно обнаружить, если капнуть на поверхность азотной кислотой, а затем на то же место – раствором поваренной соли. В присутствии серебра в сплаве появится молочное помутнение: кислота растворяет небольшое количество металла, а хлорид-ионы дают с ионами серебра белый осадок нерастворимого хлорида AgCl.
Для более точного определения пробы ювелиры используют пробирный камень – черный камень с отшлифованной матовой поверхностью. Изделием проводят по камню, а оставшийся штрих сравнивают с цветом штрихов от эталонных сплавов известной пробы.
Многие декоративные серебряные изделия покрыты красивой чернью. Для чернения используют так называемую серную печень, содержащую полисульфид калия (в основном K2S4). Под действие этого реагента на поверхности серебра образуется черная пленка сульфида Ag2S.
Соединения серебра часто неустойчивы к нагреванию и действию света. Открытие светочувствительности солей серебра привело к появлению фотографии и быстрому увеличению спроса на серебро. Еще в середине 20 во всем мире ежегодно добывалось около 10 000 тонн серебра, а расходовалось значительно больше (дефицит покрывался за счет старых запасов). Причем почти половина всего серебра шла на изготовление кино- и фотоматериалов. Так, обычная черно-белая фотопленка содержит (до проявления) до 5 г/м 2 серебра. Вытеснение черно-белых фотографий и кинофильмов цветными позволило значительно снизить потребление серебра.
Серебро применяется и в химической промышленности для изготовления катализаторов некоторых процессов, а в пищевой промышленности из серебра делают некорродирующие аппараты. Интересное, хотя и ограниченное применение находит иодид серебра; его используют для местного управления погодой путем распыления с самолетов. В присутствии даже ничтожных количеств AgI в облаках образуются крупные водяные капли, которые и выпадают в виде дождя. «Работать» могут уже мельчайшие частицы иодида серебра размером всего 0,01 мкм. Теоретически из кубического кристалла AgI размером всего 1 см можно получить 10 21 таких мельчайших частиц. Как подсчитали американские метеорологи, всего 50 кг иодида серебра вещества достаточно для «затравки» всей атмосферы над поверхностью США (а это 9 млн. квадратных километров!). Поэтому, несмотря на сравнительно высокую стоимость солей серебра, применение AgI с целью вызвать искусственный дождь оказывается практически выгодным.
Иногда требуется выполнить прямо противоположное задание: «разогнать» тучи, не дать пролиться дождю при проведении какого-либо важного мероприятия (например, Олимпийских игр). В этом случае иодид серебра нужно распылять в облаках заблаговременно, за десятки километров от места проведения торжества. Тогда дождь прольется на леса и поля, а в городе будет солнечная сухая погода.
Биохимия серебра.
Серебро не относится к биоэлементам; в живом веществе его содержание в 6 раз меньше, чем в земной коре. Однако присутствие ионов Ag + не безразлично для многих биохимических процессов.Хорошо известно бактерицидное действие малых концентраций серебра на питьевую воду. При содержании 0,05 мг/л ионы серебра обеспечивают высокую антимикробную активность, причем такую воду можно пить без вреда для здоровья. Вкус ее при этом не изменяется. (Для сравнения: для питья космонавтов допускается концентрация Ag + до 0,1 – 0,2 мг/л.). При содержании 0,1 мг/л вода консервируется на целый год, тогда как кипячение воды переводит ионы серебра в физиологически неактивную форму. Препараты серебра все шире используют для стерилизации питьевой воды (некоторые бытовые фильтры содержат «посеребренный» активированный уголь, выделяющий в воду очень малые дозы серебра). Для дезинфекции воды в бассейнах было предложено насыщать ее бромидом серебра. Насыщенный раствор AgBr содержит 7,3·10 –7 моль/л ионов серебра или около 0,08 мг/л, что безвредно для здоровья человека, но губительно для микроорганизмов и водорослей.
Бактерицидное действие ничтожных концентраций ионов серебра объясняется тем, что они вмешиваются в жизнедеятельность микробов, мешая работе биологических катализаторов – ферментов. Соединяясь с аминокислотой цистеином, входящей в состав фермента, ионы серебра препятствуют его нормальной работе. Аналогично действуют и ионы некоторых других тяжелых металлов, например, меди или ртути, но они намного токсичнее серебра. А главное – хлориды меди и ртути прекрасно растворяются в воде и потому представляют большую опасность для человека; любая же хорошо растворимая соль серебра в желудке человека под действием соляной кислоты быстро превращается в хлорид серебра, растворимость которого в воде при комнатной температуре составляет менее 2 мг/л.
Однако, как это часто бывает, то, что полезно в малых дозах, губительно в больших. Не составляет исключения и серебро. Так, введение значительных концентраций ионов серебра вызывает у животных снижение иммунитета, изменения в сосудистой и нервной тканях головного и спинного мозга, а при увеличении дозы – повреждения печени, почек, щитовидной железы. Описаны случаи отравления человека препаратами серебра с тяжелыми нарушениями психики. К счастью, в теле человека через 1–2 недели остается всего 0,02–0,1% введенного серебра, остальное выводится из организма.
При многолетней работе с серебром и его солями, когда они поступают в организм длительно, но малыми дозами, может развиться необычное заболевание – аргирия. Поступающее в организм серебро способно медленно отлагаться в виде металла в соединительной ткани и стенках капилляров разных органов, в том числе в почках, костном мозге, селезенке. Накапливаясь в коже и слизистых оболочках, серебро придает им серо-зеленую или голубоватую окраску, особенно сильную на открытых участках тела, подвергающихся действию света. Изредка окраска может быть настолько интенсивной, что кожа напоминает кожу негров.
Развивается аргирия очень медленно, первые ее признаки появляются через 2–4 года непрерывной работы с серебром, а сильное потемнение кожи наблюдается лишь спустя десятки лет. Раньше всего темнеют губы, виски и конъюнктива глаз, затем веки. Сильно могут быть окрашены слизистые оболочки рта и десны, а также лунки ногтей. Иногда аргирия проявляется в виде мелких сине-черных пятен. Раз появившись, аргирия не исчезает, и вернуть коже ее прежний цвет не удается. Если не считать чисто косметических неудобств, больной аргирией может не испытывать никаких болезненных ощущений или расстройств самочувствия (если не поражены роговица и хрусталик глаза); в этом отношении аргирию можно назвать болезнью лишь условно. Есть у этой болезни и своя «ложка меда» – при аргирии не бывает инфекционных заболеваний: человек настолько «пропитан» серебром, что оно убивает все болезнетворные бактерии, попадающие в организм.
Илья Леенсон
Серебро в медицине.
О том, что серебро металл ценный, знают все. Но не всем известно, что этот металл может и исцелять. Если хранить воду в серебряных сосудах или просто в контакте с серебряными изделиями, то мельчайшие частички серебра – ионы Ag + – переходят в раствор и убивают микроорганизмы и бактерии. Такая вода долго не портится и не «зацветает».
Об этом свойстве серебра знали очень давно. Персидский царь Кир II Великий (558–529 до н.э.) пользовался серебряными сосудами для хранения питьевой воды во время своих военных походов. Знатные римские легионеры носили нагрудники и налокотники из серебряных пластинок: при ранении прикосновение такой пластинки предохраняло от инфекции.
В 326 до н.э. воины Александра Македонского (365–326 до н.э.) вторглись в Индию. На берегах реки Инд в войсках разразилась эпидемия желудочно-кишечных заболеваний, которые, как ни странно, не затронули ни одного военачальника. Оказалось, что простые воины пользовались оловянной посудой, а их начальники – серебряной. Этого оказалось достаточно для дезинфекции воды и пищи. Можно попробовать дома получить «серебряную» воду и убедиться в ее удивительных свойствах.
Существуют и «серебряные» лекарства (колларгол, протаргол, ляпис и др.).
Колларгол (коллоидное серебро) – зеленовато- или синевато-черные чешуйки с металлическим блеском; в воде они образуют коллоидный раствор.
Это лекарство появилось в 1902, когда немецкий химик Карл Пааль придумал способ, как защитить мельчайшие частички серебра: надо, чтобы вокруг каждой из них образовалась тончайшая оболочка из белка альбумина, который содержится в курином яйце, тогда эти частички не будут слипаться. Колларгол содержит до 70% серебра. Применяют его в виде 0,2–1,0%-го водного (коллоидного) раствора для промывания гнойных ран и глаз при конъюнктивите, 1–2%-м раствором лечат воспаление мочевого пузыря, а 2–5%-м – гнойный насморк.
Протаргол – это серебросодержащее белковое соединение, коричнево-желтый или коричневый порошок без запаха, хорошо растворимый в воде. Содержание серебра в нем – 7,8–8,3%. Протаргол применяют для тех же целей, что и колларгол. Жидкую смесь, состоящую из 0,2 г протаргола, 5 мл глицерина и 15 мл воды, используют для орошения голосовых связок, а 1–3%-й раствор протаргола успешно лечит насморк и конъюнктивит.
Ляпис – нитрат серебра AgNO3 впервые применили врачи-алхимики голландец Ян-Баптист ван Гельмонт (1579–1644) и немец Франциск де ла Бое Сильвий (1614–1672), которые научились получать нитрат серебра взаимодействием металла с азотной кислотой.
При этом протекает реакция:
Тогда-то и было обнаружено, что прикосновение к кристаллам полученной серебряной соли не проходит бесследно: на коже остаются черные пятна, а при длительном контакте – глубокие ожоги. Нитрат серебра – бесцветный (белый) порошок, хорошо растворимый в воде, на свету он чернеет с выделением металлического серебра.
Медицинский ляпис, строго говоря, не чистый нитрат серебра, а его сплав с нитратом калия, иногда отлитый в виде палочек – ляписного карандаша. Ляпис оказывает прижигающее действие и применяется с давних пор. Однако пользоваться им надо чрезвычайно аккуратно: нитрат серебра может вызвать отравления и сильные ожоги. Хранить ляпис следует в местах, недоступных детям!
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство, более концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани. Это связано с образованием альбуминатов (белковых соединений) серебра при соприкосновении с кожей. Раньше ляпис применяли для удаления мозолей и бородавок, прижигания угрей. Да и теперь, если нет возможности прибегнуть к криотерапии (прижиганию сухим льдом или жидким азотом), чтобы безболезненно избавиться от ненужных наростов, пользуются ляписом.
Людмила Аликберова
Максимов М.М. Очерк о серебре. М., Недра, 1981
Кульский Л.А. Серебряная вода. Киев, Наукова думка, 1982
Малышев В.М., Румянцев Д.В.. Серебро. М., Металлургия, 1987
Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М., Химия, 1992
Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. – 2-е изд. М., Химия, 1995
Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов / Р.А. Лидин, В.А. Молочко, Л.Л.Андреева; под ред. Р.А. Лидина. М., Химия, 1996
Здорик Т., Фельдман Л. Энциклопедия природы России. Минералы и горные породы. М., 1998
Аликберова Л.Ю. Занимательная химия: Книга для учащихся, учителей и родителей. М., АСТ-ПРЕСС, 1999
Степин Б.Д., Аликберова Л.Ю., Рукк Н.С. Домашняя химия. Химия в быту и на каждый день. М., РЭТ, 2001
Серебро

Серебро (Ag от лат. Argentum ) — элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47.
Простое вещество серебро — ковкий, пластичный благородный металл серебристо-белого цвета. Кристаллическая решётка — гранецентрированная кубическая. Температура плавления — 962 °C, плотность — 10,5 г/см³.
1‑я: 730,5 кДж/моль (эВ)
2‑я: 2070 кДж/моль (эВ)
Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 Месторождения
- 5.1 В медицине

История
Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. Одним из древнейших центров добычи и обработки серебра была доисторическая Сардиния, где оно было известно с раннего энеолита.
В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В Средние века серебро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки юбилейных монет (выход из оборота последних серебряных монет в 1960—1970-е годы примерно совпал с кризисом Бреттон-Вудской валютной системы).
Происхождение названия
Славянские названия металла — рус. серебро , польск. srebro , болг. сребро , ст.‑слав. сьребро — восходят к праславянскому *sьrebro, которое имеет соответствия в балтийских (лит. sidabras , др.-прусск. sirablan) и германских (готск. silubr , нем. Silber , англ. silver ) языках. Дальнейшая этимология за пределами германо-балто-славянского круга языков неясна, предполагают либо происхождение от той же основы, что и анатолийское subau-ro «блестящий», либо раннее заимствование из языков Ближнего Востока: ср. аккад. sarpu «очищенное серебро», от аккад. sarapu «очищать, выплавлять», или из доиндоевропейских языков древней Европы: ср. баск. zilar .
Греческое название серебра ἄργυρος, árgyros произошло от индоевропейского корня *H₂erǵó-, *H₂erǵí-, означающего «белый, блистающий». Из того же корня происходит и его латинское название — argentum.
Нахождение в природе
Среднее содержание серебра в земной коре (по Виноградову) — 70 мг/т. Максимальные его концентрации устанавливаются в глинистых сланцах, где достигают 1 г/т. Серебро характеризуется относительно низким энергетическим показателем ионов, что обуславливает незначительное проявление изоморфизма этого элемента и сравнительно трудное его вхождение в решётку других минералов. Наблюдается лишь постоянный изоморфизм ионов серебра и свинца. Ионы серебра входят в решётку самородного золота, количество которого иногда достигает в электруме почти 50 % по массе. В небольшом количестве ион серебра входит в решётку сульфидов и сульфосолей меди, а также в состав теллуридов, развитых в некоторых полиметаллических и особенно, в золото-сульфидных и золото-кварцевых месторождениях.
Определённая часть благородных и цветных металлов встречается в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра. Так, например, в 1477 году на руднике «Святой Георгий» (месторождение Шнееберг в Рудных горах в 40—45 км от города Фрайберг) был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1×1×2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили. В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 году на норвежском руднике Конгсберг. Крупные самородки обнаруживали и на других континентах. В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт в Канаде самородных пластин серебра, имеющая вес 612 кг. Другая пластина, найденная на том же месторождении и получившая за свои размеры название «серебряный тротуар», имела длину около 30 м и содержала 20 т серебра. Однако, при всей внушительности когда-либо обнаруженных находок, следует отметить, что серебро химически более активно, чем золото, и по этой причине реже встречается в природе в самородном виде. По этой же причине растворимость серебра выше и его концентрация в морской воде на порядок больше, чем у золота (около 0,04 мкг/л и 0,004 мкг/л соответственно).

Известно более 50 природных минералов серебра, из которых важное промышленное значение имеют лишь 15—20, в том числе:
- самородное серебро;
- электрум (золото-серебро);
- кюстелит (серебро-золото);
- аргентит (серебро-сера);
- прустит (серебро-мышьяк-сера);
- бромаргерит (серебро-бром);
- кераргирит (серебро-хлор);
- пираргирит (серебро-сурьма-сера);
- стефанит (серебро-сурьма-сера);
- полибазит (серебро-медь-сурьма-сера);
- фрейбергит (медь-сера-серебро);
- аргентоярозит (серебро-железо-сера);
- дискразит (серебро-сурьма);
- агвиларит (серебро-селен-сера)
Как и другим благородным металлам, серебру свойственны два типа проявлений:
- собственно серебряные месторождения, где оно составляет более 50 % стоимости всех полезных компонентов;
- комплексные серебросодержащие месторождения (в которых серебро входит в состав руд цветных, легирующих и благородных металлов в качестве попутного компонента).
Собственно серебряные месторождения играют достаточно существенную роль в мировой добыче серебра, однако следует отметить, что основные разведанные запасы серебра (75 %) приходятся на долю комплексных месторождений.
Содержание серебра в рудах цветных металлов 10-100 г/т, в золото-серебряных рудах 200—1000 г/т, а в рудах серебряных месторождений 900—2000 г/т, иногда десятки килограммов на тонну.
Серебро встречается и в каустоболитах: торфах, нефти, угле, битуминозных сланцах.
Месторождения
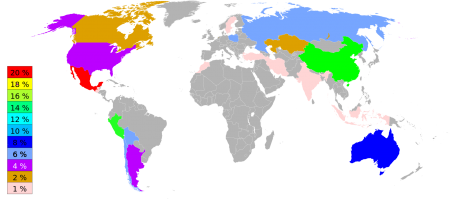
Значительные месторождения серебра расположены на территориях следующих стран:
- Армении,
- Германии,
- Испании,
- Перу,
- Чили,
- Мексики,
- Китая,
- Канады,
- США,
- Австралии,
- Польши,
- России,
- Казахстана,
- Румынии,
- Швеции,
- Чехии,
- Словакии,
- Австрии,
- Венгрии,
- Норвегии.
Также месторождения серебра есть на Кипре и на Сардинии.
Физические свойства

Серебряная монета
Чистое серебро — довольно тяжёлый (легче свинца, но тяжелее меди, плотность — 10,5 г/см³), необычайно пластичный серебристо-белый металл (коэффициент отражения света близок к 100 %). Тонкая серебряная фольга в проходящем свете имеет фиолетовый цвет. С течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида, чья тонкая плёнка придаёт тогда металлу характерную розоватую окраску. Обладает самой высокой теплопроводностью среди металлов. При комнатной температуре имеет самую высокую электропроводность среди всех известных металлов (удельное электрическое сопротивление 1,59⋅10 −8 Ом·м при температуре 20 °C). Относительно тугоплавкий металл, температура плавления 962 °C.
Химические свойства
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
Растворяется оно и в хлорном железе, что применяется для травления:
Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра).
Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий:
В отсутствии кислорода:
Свободные галогены легко окисляют серебро до галогенидов:
Однако на свету эта реакция обращается, и галогениды серебра (кроме фторида) постепенно разлагаются. На этом явлении основан принцип чёрно-белой фотографии.
При нагревании с серой серебро даёт сульфид:
Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2] + . Серебро образует комплексы также с цианидами, тиосульфатами. Комплексообразование используют для растворения малорастворимых соединений серебра, для извлечения серебра из руд. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, перхлорат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
Применение

- Так как обладает наибольшей электропроводностью, теплопроводностью и стойкостью к окислению кислородом при обычных условиях, применяется для контактов электротехнических изделий (например, контакты реле, ламели), а также многослойных керамических конденсаторов.
- В составе припоев: медносеребряные припои ПСр-72, ПСр-45 и другие, используется для пайки разнообразных ответственных соединений, в том числе разнородных металлов, припои с высоким содержанием серебра используются в ювелирных изделиях, а со средним — в разнообразной технике, от сильноточных выключателей до жидкостных ракетных двигателей, иногда также как добавка к свинцу в количестве 3 % (ПСр-3), им заменяют оловянный припой.
- В составе сплавов: для изготовления катодов гальванических элементов.
- Применяется как драгоценный металл в ювелирном деле (обычно в сплаве с медью, иногда с никелем и другими металлами).
- Используется при чеканке монет (оборотных — до начала 1970-х годов, сейчас — только юбилейных), а также наград — орденов и медалей.
- Галогениды серебра и нитрат серебра используются в фотографии, так как обладают высокой светочувствительностью.
- Иодистое серебро применяется для смены погоды («разгон облаков»).
- Из-за высочайшей электропроводности и стойкости к окислению применяется:
- в электротехнике и электронике как покрытие ответственных контактов и проводников в высокочастотных цепях;
- в СВЧ-технике как покрытие внутренней поверхности волноводов.
Области применения серебра постоянно расширяются, и его применение — это не только сплавы, но и химические соединения. Определённое количество серебра постоянно расходуется для производства серебряно-цинковых и серебряно-кадмиевых аккумуляторных батарей, обладающих очень высокой энергоплотностью и массовой энергоёмкостью и способных при малом внутреннем сопротивлении выдавать в нагрузку очень большие токи.
Серебро используется в качестве добавки (0,1—0,4 %) к свинцу для отливки токоотводов положительных пластин специальных свинцовых аккумуляторов, имеющих очень большой срок службы (до 10—12 лет) и малое внутреннее сопротивление.
Хлорид серебра используется в хлор-серебряно-цинковых батареях, а также для покрытий некоторых радарных поверхностей. Кроме того, хлорид серебра, прозрачный в инфракрасной области спектра, используется в инфракрасной оптике.
Монокристаллы фторида серебра используются для генерации лазерного излучения с длиной волны 0,193 мкм (ультрафиолетовое излучение).
Серебро используется в качестве катализатора в фильтрах противогазов.
Ацетиленид серебра (карбид) изредка применяется как мощное инициирующее взрывчатое вещество (детонаторы).
Фосфат серебра используется для варки специального стекла, используемого для дозиметрии излучений. Примерный состав такого стекла: фосфат алюминия — 42 %, фосфат бария — 25 %, фосфат калия — 25 %, фосфат серебра — 8 %.
Перманганат серебра, кристаллический тёмно-фиолетовый порошок, растворимый в воде; используется в противогазах. В некоторых специальных случаях серебро также используется в сухих гальванических элементах следующих систем: хлор-серебряный элемент, бром-серебряный элемент, йод-серебряный элемент.
Серебро зарегистрировано в качестве пищевой добавки E174.
В медицине
До середины ХХ века нитрат серебра использовался в качестве наружного антисептика под названием ляпис. На свету он разлагается на свободное серебро, диоксид азота и молекулярный кислород. Однако в настоящее время во всех сферах применяется множество значительно более эффективных антисептиков.
Начиная с 1990 года, в нетрадиционной медицине наблюдается возрождение использования коллоидного серебра в качестве средства для лечения многочисленных болезней. В лабораторных исследованиях получены разные результаты: в одних исследований показано, что антимикробное воздействие серебра весьма незначительно, в то время как другие показали, что раствор 5—30 ppm является эффективным против стафилококка и кишечной палочки. Данное противоречие связано с размерами коллоидных наночастиц серебра — чем меньше их размер, тем более выражен антимикробный эффект. Следует отметить, что подобные свойства наночастиц характерны для большинства переходных металлов и связаны с разрушением клеточной мембраны бактерий при сорбции наночастицы. Это, однако, проявляется только в очень чистых растворах.
Серебро — это тяжёлый металл, содержание которого в питьевой воде регламентировано СанПиН 2.1.4.1074-01 «Вода питьевая» — серебру присвоен класс опасности 2, «высокоопасное вещество». Госсанэпидемнадзор официально утвердил гигиенические нормативы содержания вредных веществ в питьевой воде, в этих нормативах содержание серебра в питьевой воде ограничено концентрацией 0,05 мг/л.
В США и Австралии препараты на основе коллоидного серебра не признаны лекарствами и предлагаются в продовольственных магазинах. Также в изобилии их можно встретить в Интернет-магазинах по всему миру в качестве БАД (биологически активных добавок), более простое название — пищевые добавки. Законом США и Австралии было запрещено маркетологам приписывать медицинскую эффективность коллоидному серебру. Но некоторые сайты, в том числе на их территории, по-прежнему указывают на благотворное воздействие препарата при профилактике простуды и гриппа, а также на лечебное воздействие при более серьёзных заболеваниях, таких, как диабет, рак, синдром хронической усталости, ВИЧ/СПИД, туберкулёз, и другие заболевания. Нет никаких медицинских исследований, свидетельствующих о том, что коллоидное серебро эффективно для какого-либо из этих заявленных симптомов.
До эпохи доказательной медицины растворы солей серебра широко применяли в качестве антисептических и вяжущих средств. На этом свойстве серебра основано действие таких лекарственных препаратов, как протаргол, колларгол и др., представляющих собой коллоидные формы серебра. В настоящее время препараты серебра применяются всё реже в связи с низкой эффективностью.
Физиологическое действие
Следы серебра (порядка 0,02 мг/кг) содержатся в организмах всех млекопитающих, но его биологическая роль недостаточно изучена. Головной мозг человека характеризуется повышенным содержанием серебра (0,03 мг на 1000 г свежей ткани, или 0,002 % по массе в золе). Интересно, что в изолированных ядрах нервных клеток — нейронов — серебра гораздо больше (0,08 % по массе в золе).
С пищевым рационом человек получает в среднем около 0,1 мг Ag в сутки. Относительно много его содержит яичный желток (0,2 мг в 100 г). Выводится серебро из организма главным образом с калом.
Ионы серебра обладают бактериостатическими свойствами. Однако для достижения бактериостатического эффекта концентрацию ионов серебра в воде необходимо повысить настолько, что она становится непригодной для питья. Бактериостатические свойства серебра известны с древности. В VI веке до н. э. персидский царь Кир II Великий в своих военных походах использовал серебряные сосуды для хранения воды. Покрытие поверхностных ран серебряными пластинами практиковалось ещё в древнем Египте. Очистку больших количеств воды, основанную на бактерицидном действии серебра, особенно удобно производить электрохимическим путём.
В начале 1970-х годов нижний предел бактериостатического действия серебра оценивался содержанием его в воде порядка 1 мкг/л. По данным 2009 года — нижний предел действия находится на уровне 50—300 мкг/л, что уже опасно для человека.
Как и все тяжёлые металлы, серебро при избыточном поступлении в организм токсично.
По санитарным нормам США содержание серебра в питьевой воде не должно превышать 0,05 мг/л. Согласно действующим российским санитарным нормам серебро относится к высокоопасным веществам (класс опасности 2 по санитарно-токсикологическому признаку вредности), и предельно допустимая концентрация серебра в питьевой воде составляет те же 0,05 мг/л.
При длительном поступлении в организм избыточных доз серебра развивается аргирия, внешне выражающаяся серой окраской слизистых оболочек и кожи, причём преимущественно на освещённых участках тела, что обусловлено отложением частичек восстановленного серебра. Какие-либо расстройства самочувствия заболевших аргирией наблюдаются далеко не всегда. Вместе с тем, немедицинскими источниками отмечалось, что они не подвержены инфекционным заболеваниям.
Ионы серебра оказывают генотоксичный эффект, разрушая целостность молекул ДНК в клетках, в том числе вызывая перестройки в хромосомах и фрагментацию последних. Кроме того, исследователи выявили повреждения генов в сперматозоидах.
Добыча
Серебро было известно с глубокой древности (4-е тысячелетие до н. э.) в Египте, Персии, Китае.
Значительным источником извлечённого серебра (не в виде самородков) считается территория Анатолии (современная Турция). Добываемое серебро поступало в основном на Ближний Восток, в Крит и Грецию.
Более или менее значительные данные о добыче серебра относятся к периоду после III тысячелетия до н. э., например, известно, что халдеи в 2500 году до н. э. извлекали металл из свинцово-серебряных руд.
После 1200-х годов до н. э. центр производства металла сместился в Грецию, в Лаврион, недалеко от Афин. Шахты были весьма богаты: их добыча с 600 до 300 года до н. э. составляла около 1 млн тройских унций (30 т) в год. В течение почти тысячи лет они оставались самым крупным источником серебра в мире.
С IV по середину I века до н. э. лидером по производству серебра были Испания и Карфаген.
Во II—XIII веках действовало множество рудников по всей Европе, которые постепенно истощались.
По мере расширения торговых связей, требующих денежного обращения, в XII—XIII веках выросла добыча серебра в Гарце, Тироле (главный центр добычи — Швац), Рудных горах, позднее в Силезии, Трансильвании, Карпатах и Швеции. С середины XIII до середины XV веков ежегодная добыча серебра в Европе составляла 25—30 т; во 2-й половине XV века она достигала 45—50 т в год. На германских серебряных рудниках в это время работало около 100 тысяч человек. Крупнейшим из старых месторождений самородного серебра является открытое в 1623 году месторождение Конгсберг в Норвегии.
Освоение Америки привело к открытию богатейших месторождений серебра в Кордильерах. Главным источником становится Мексика, где в 1521—1945 годах было добыто около 205 тыс. т металла — около трети всей добычи за этот период. В крупнейшем месторождении Южной Америки — Потоси — за период с 1556 по 1783 год добыто серебра на 820 513 893 песо и 6 «прочных реалов» (последний в 1732 году равнялся 85 мараведи).
В России первое серебро было выплавлено в июле 1687 года российским рудознатцем Лаврентием Нейгартом из руд Аргунского месторождения (Нерчинский горный округ). В 1701 году в Забайкалье был построен первый сереброплавильный завод, который на постоянной основе стал выплавлять серебро 3 года спустя. Некоторое количество серебра добывалось на Алтае. Лишь в середине XX века освоены многочисленные месторождения на Дальнем Востоке.
В 2008 году всего добыто 20 900 т серебра. Лидером добычи является Перу (3600 т), далее следуют Мексика (3000 т), Китай (2600 т), Чили (2000 т), Австралия (1800 т), Польша (1300 т), США (1120 т), Канада (800 т).
На 2008 год лидером добычи серебра в России является компания «Полиметалл», добывшая в 2008 году 535 т. В 2009 и 2010 годах «Полиметалл» добыл по 538 т серебра, в 2011 году — 619 т.
Мировая добыча серебра (1990-2017) (1990-2007 — данные U.S. Geological Survey, 2008-2017 — данные The Silver Institute)
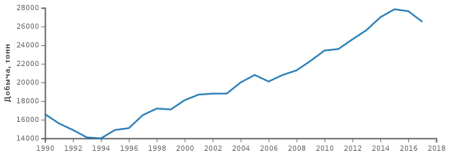
Мировые запасы серебра оцениваются в 505 тыс. т (на 1986 год), подтверждённые — 360 тыс. т.
В мифологии
В мифологии многих народов серебру приписываются магические свойства, способность отгонять всяческую нечисть — оборотней, вампиров, злых духов и так далее.
Серебро

Серебро — Ag, минерал класса самородных элементов, кристаллизуется в кубической сингонии, кубически-гексоктаэдрический вид симметрии. Встречается в аргенитах (сульфид) и роговом серебре (хлорид серебра), добывается также как побочный товар очистки купрума и свинца. Серебро было одним из первых металлов, освоенных человеком. Является великолепным проводником тепла и электричества. Главным производителем серебра является Мексика, хотя серебряные руды разбросаны по всему миру.
СТРУКТУРА

Кристаллическая структура серебра
Сингония кубическая; гексаоктаэдрический в. с. ЗL 4 4L6 3 6L 2 9РС. Кристаллическая структура. Гранецентрированный куб. Облик кристаллов. Правильно образованные кристаллы очень редки. Встречающиеся формы: , . Двойники по (111). Агрегаты. Встречается иногда в виде типичных “вязаных” перистых дендритов, тонких неправильных пластин и листочков. Характерны также моховидные, волосовидные и проводочные формы. Наиболее распространены зерна неправильной формы и более крупные сплошные скопления – самородки.
СВОЙСТВА

Цвет серебряно-белый, часто с жёлтой, коричневой или черной побежалостью. Серебро с поверхности довольно быстро окисляется на воздухе и тем быстрее, чем больше примесей оно содержит, при этом цвет поверхности изменяется до чёрного с отливом различных оттенков. Блеск металлический до матового, цвет черты серебряно-белый, блестящий. Твердость 2,5 —3. Плотность 9,6 —12. Спайность отсутствует, излом раковистый. Весьма пластичное, гибкое, ковкое. Обладает максимальной среди металлов тепло- и электропроводностью. Является диамагнетиком. Под паяльной трубкой легко плавится. С НСI реагирует, образуя белый творожистый осадок (АgCl). Реакция с Н2S дает чёрное окрашивание.
ЗАПАСЫ И ДОБЫЧА

Серебро на акантите, 2.3 x 1.8 x 1.1 см, Перу, шахта Учукчакуа
По СССР крупные месторождения не известны. Самородки серебра в прежнее время находили в Турьинских рудниках на Северном Урале, в ряде свинцово-цинковых месторождений Алтая, Казахстана, Восточной Сибири и в других местах.
Из иностранных месторождений большой известностью пользовались месторождения: Конгсберг(Норвегия), где самородное серебро встречалось до глубины 900 м, Кобальт(Канада), Шнееберг(Германия).
Добыча серебросодержащих руд может производиться подземным или открытым способом. Сначала при помощи специальных приборов геологоразведчики проверяют шахты под землей на предмет содержания полезных ископаемых и драгоценных металлов. После обнаружения богатых серебром участков в соответствующих местах делают отверстия, в которые закладывают взрывчатку. Поднятые взрывом на поверхность шахты осколки серебросодержащей руды измельчают промышленным способом. Из руды драгоценный металл извлекают методами амальгации и цианирования.ПРОИСХОЖДЕНИЕ

Серебро, ширина 1 см, Марокко, шахта Имитер
Образование самородного серебра в природе во многом аналогично образованию меди. Оно вместе с другими серебросодержащими минералами встречается в гидротермальных жильных месторождениях в ассоциации с аргентитом (Ag2S) и кальцитом (месторождение Конгсберг в Норвегии), иногда в ассоциации со сложными сернистыми, мышьяковистыми, сурьмянистыми соединениями разных металлов, в том числе никеля и кобальта.
В экзогенных условиях оно, так же как и самородная медь, встречается в зонах окисления месторождений сернистых и мышьяково-сурьмянистых руд, являясь продуктом их разложения и восстановления из поверхностных растворов различными органическими соединениями. Образующееся в этих условиях самородное серебро нередко имеет вид дендритов, пластинок, моховидных, проволочных, волосовидных форм и др. Экспериментально доказано, что тончайшие нитевидные и дендритовые образования, иногда в виде красивых узоров, образуются на кусочках угля из раствора, особенно в присутствии растворимых органических соединений.
В поверхностных условиях самородное серебро менее устойчиво, чем золото. Оно часто покрывается пленками и примазками черного цвета. В местностях с жарким, сухим климатом с поверхности нередко переходит в устойчивые галоидные соединения (AgCl и др.).ПРИМЕНЕНИЕ

Серебро применяется главным образом в сплавах с медью для выделки серебряных изделий, монет и др. Чистое серебро употребляется для филигранных работ, изготовления тиглей для плавления щелочей, для серебрения, для получения химических соединений и других целей. Главная масса серебра (около 80%) добывается не в самородном виде, а в качестве побочного продукта из богатых серебром свинцово-цинковых, золотых и медных месторождений.
Области применения серебра постоянно расширяются, и его применение — это не только сплавы, но и химические соединения. Определённое количество серебра постоянно расходуется для производства серебряно-цинковых и серебряно-кадмиевых аккумуляторных батарей, обладающих очень высокой энергоплотностью и массовой энергоёмкостью и способных при малом внутреннем сопротивлении выдавать в нагрузку очень большие токи.Источник https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/SEREBRO.html
Источник https://chem.ru/serebro.html
Источник https://mineralpro.ru/minerals/silver/




