В воде не тонет — какой металл настолько легкий, что может плавать в любой жидкости (4 фото + видео)

Из 118 элементов, представленных в основной химической таблице, начатой Дмитрием Менделеевым, к металлам относят более 90 элементов. Это обстоятельство позволило сравнивать, анализировать их свойства и характеристики.
Многолетние опыты показали, что металлы разительно отличаются друг от друга. Это позволило ученым поделить их на локальные группы, вещества в которых имеют схожие признаки, а значит, могут использоваться в определенных условиях.
Кроме щелочных, легких, щелочноземельных металлов и тех, что входят в группы лантаноидов, актиноидов и полуметаллов, есть переходные. Но и те, что находятся в смежных группах, иногда обладают схожими свойствами.

В воде литий не тонет, но, как и все щелочи, вступает в реакцию
Так, к легким металлам относятся 7 элементов: Al, Ga, In, Sn, Tl, Pb, Bi. Но по признаку твердости, плотности, температуры плавления или кипения, а также электроотрицательности, некоторые металлы могут посоревноваться с «легкоатлетами», например скандий, стронций и литий.
- 1 Неофициальное соревнование
- 2 Немного о победителе
Неофициальное соревнование
Это сравнение, конечно, не воспринимается химиками, но для тех, кто занимается химией на любительском уровне, за «фактор легкости» можно принять плотность веществ и посмотреть какой металл действительно самый легкий на планете.
Итак, плотность стронция 5,7 г/см3, у скандия этот показатель значительно ниже — 2,99 г/см3, алюминий и того легче, он занимает 2,7 г/см3. Просматривая данную характеристику каждого металла, можно обнаружить, что самым незначительным по плотности, а значит, легким, является литий.

Литий горит ярким алым пламенем
Немного о победителе
Плотность лития 0,53 г/см3. Это значение почти в 2 раза ниже, чем у обычной не перенасыщенной различными изотопами воды. От чего даже большой кусок данного металла со сторонами 5х5 см не будет весить и 50-ти грамм. Для сравнения — примерно то же количество железа весило бы около 700 грамм, что в 14 раз больше.
В отличие от участников «гонки» литий режется гораздо хуже. Но в первые минуты после нарушения целостности куска, можно увидеть металлический блеск, который за секунды тускнеет, вступая в реакцию с воздухом. Во время взаимодействия с О2 образуется нитрид и оксид лития.

Mеталл используют для производства литиевых и литий-ионных батарей
Плотность лития мала, ее можно сравнить по плотности с сухой веткой. Поэтому в любой жидкости даже достаточно крупный кусок металла будет всплывать.
Если сравнить 1 грамм лития и грамм самого плотного металла осмия можно наглядно увидеть разницу. Грамм лития будет намного больше, примерно в 40 раз. Поэтому плотность твердых веществ можно сравнивать даже по внешнему виду.
Литий, входящий в группу щелочных металлов, взаимодействует с водой. На поверхности появляются пузырьки — водород, который можно поджечь. Получается достаточно увлекательное зрелище – плавающий металл, который горит алым пламенем прямо в воде. Ровно также ярко и активно литий горит в воздухе.
Применяют его в литиевых аккумуляторах, в виде кобальтата, добавляя примеси других добавок. Зону применения обусловили электрохимические характеристики. Такой аккумулятор выдает большое напряжение. Однако из-за высокой цены ученые ищут ему столь же эффективный аналог.
Новости
Металл, который может плавать на поверхности воды
Радикально новый материал может привести к созданию нетонущих кораблей, а также может повысить экономию топлива в сверхлёгких автомобилях, поскольку сочетает в себе лёгкий вес с термостойкостью.
Исследователи продемонстрировали новый тип металла, настолько лёгкий, что он может плавать на поверхности воды.

Материал был создан Deep Springs Technology и политехнической Инженерной школой Нью-Йоркского университета совместно с армией США.
Новый материал представляет собой синтактическую пену (композит, наполнителем в котором являются полые сферические частицы) с металлической матрицей. Способность металлов выдерживать более высокие температуры может быть огромным преимуществом таких композитов для применения в двигателях и компонентах выхлопных газов.
Матрица композита представляет собой магниевый сплав, армированный полыми частицами карбида кремния. Композит имеет плотность 0,92 г/см 3 по сравнению с плотностью воды 1,0 г/см 3 .
Кроме более низкой, по сравнению с водой, плотности, новый композит достаточно прочный, чтобы выдерживать жесткие условия, с которыми сталкиваются в морской среде. Секрет прочности материала кроется в металлической матрице, которая затем превращается в пену добавлением в неё прочных и лёгких полых сфер из карбида кремния. Оболочка каждой сферы может выдерживать давление более 25000 фунтов на квадратный дюйм (PSI), что в 100 раз больше максимального давления в пожарном шланге. Полые частицы также действуют как защита от ударов, поскольку каждая оболочка при разрыве действует как поглотитель энергии.
Плотность и другие свойства новых композитов могут меняться в зависимости от требований к материалу, это легко делается увеличением или уменьшением количества сфер в металлической матрице.
Такая концепция изготовления материала также может быть использована с другими, негорючими магниевыми сплавами.
Прототипы нового композита могут появиться для испытаний в течение трех лет.
В будущем новый композит имеет все шансы использоваться для полов лодок, автомобильных деталей, а также автомобильной брони.
Натрий
В 1807 г. английский химик Хемфри Дэви впервые получил металлический натрий путем электролиза гидроксида натрия. Электролиз — это разложение вещества на составные части при прохождении через его раствор электрического тока.
Натрий является щелочным металлом 1-й группы. У атома натрия 11 протонов и 11 электронов с одним валентным электроном на внешней оболочке.
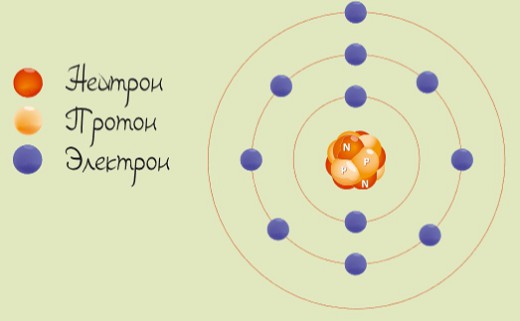
Характеристики и свойства
Натрий представляет собой мягкий пластичный металл серебристо-белого цвета с блеском на срезе. Отличительной особенностью натрия является его быстрое окисление при взаимодействии с воздухом. Именно поэтому в химических лабораториях натрий хранят в стеклянных банках под слоем керосина и используют с учетом повышенных мер безопасности, а для проведения опытов используют минимальные количества этого металла.

Натрий — довольно легкий металл, который плавает на поверхности воды. Однако как только он вступает в контакт с водой, он пузырится, а затем и загорается ярко-желтым пламенем, а при взаимодействии натрия со льдом происходит взрыв.
Нахождение в природе
Натрий считается одним из самых распространенных химических элементов, однако из-за повышенной активности в чистом виде натрия в природе не существует. Чаще всего он встречается в соединении с хлором, а хлорид натрия — это не что иное, как поваренная соль, которая есть в доме каждого из нас. В природе хлорид натрия содержится в морской воде, соленых озерах и подземных месторождениях.

Где используется?
Для простого обывателя натрий — это, прежде всего, поваренная соль (NaCI) и пищевая сода (NaHCO3). Как используется поваренная соль, тебе объяснять не надо, а вот пищевая сода, или бикарбонат натрия, применяется в кулинарии как основной или дополнительный разрыхлитель теста во время выпечки, для производства различных газированных напитков и кондитерских изделий.
Широкое применение сплавы натрия с другими металлами находят в текстильной, стекольной, бумажной и прочих отраслях промышленности, в медицине и фотографии, атомной энергетике и металлургическом производстве. В химической промышленности натрий идет на производство удобрений. Использование солей натрия в строительной индустрии в качестве противоморозной добавки к бетону позволяет проводить работы при довольно низких температурах.
ВНИМАНИЕ! Натрий чрезвычайно опасен: он воспламеняется и взрывается даже при прикосновении к нему голыми руками из-за влажности кожи!
Важность натрия для человека
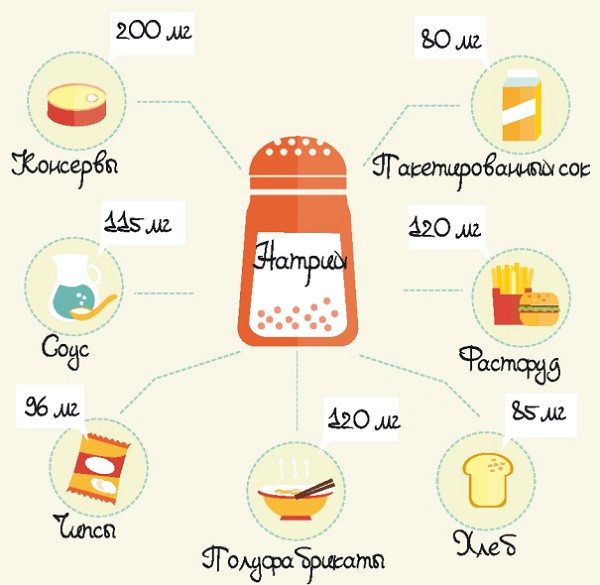
Натрий является одним из чрезвычайно важных элементов для человека, так как он содержится во всех органах, тканях и жидкостях. Натрий помогает поддерживать баланс жидкости в клетках. Поскольку этот элемент организмом не вырабатывается, а его запасы постоянно истощаются, мы должны получать его извне, с пищей. Натрий содержится практически во всех продуктах, тем не менее, большую его часть (почти 80%) наш организм получает из поваренной соли.

Морепродукты, гречневая, рисовая, овсяная и перловая крупы, молочные продукты, куриные яйца, бобовые, морковь, сельдерей, свекла, капуста и мясные субпродукты — основные источники натрия для нашего организма
Последствия недостатка
Признаки дефицита натрия в организме: обезвоживание, повышенная утомляемость, общая слабость, головокружение, рвота и тошнота. А избыток натрия проявляется в виде сильных отеков ног и лица, чувства жажды и повышения кровяного давления.
Источник https://nlo-mir.ru/chudesa-nauki/v-vode-ne-tonet.html
Источник https://worldofmaterials.ru/264-metall-kotoryj-mozhet-plavat-na-poverkhnosti-vody
Источник https://sitekid.ru/himiya/natrij.html





