Ртуть

Ртуть (Hg, от лат. Hydrargyrum ) — элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка (побочной подгруппе II группы). Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты, контаминант. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром). Название на английском — Mercury.

Тяжёлый жидкий металл серебристо-белого цвета
Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 Месторождения
- 7.1 Характерные степени окисления
- 7.2 Свойства металлической ртути
- 8.1 Медицина
- 8.2 Техника
- 8.3 Металлургия
- 8.4 Химическая промышленность
- 8.5 Сельское хозяйство
- 9.1 Гигиеническое нормирование концентраций ртути
- 9.2 Демеркуризация
- 9.3 Запрет использования содержащей ртуть продукции
История

Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Русское название ртути происходит от праслав. *rьtǫtь , связанного с лит. rìsti «катиться». Символ Hg заимствован от латинского алхимического названия этого элемента hydrargyrum (от др.-греч. ὕδωρ «вода» и ἄργυρος «серебро»).
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
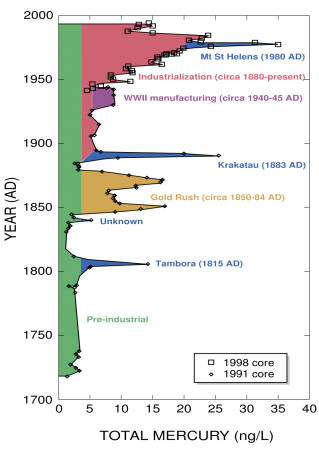
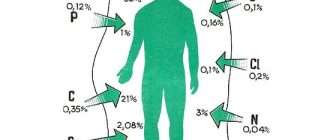
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
HgS + O2 ⟶ Hg + SO2↑ HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
10 самых тяжелых металлов в мире по плотности

Мы все любим металлы. Машины, велосипеды, кухонная техника, банки для напитков и множество других вещей — все они состоят из металла. Металл — краеугольный камень нашей жизни. Но иногда он бывает очень тяжелым.
Когда мы говорим о тяжести того или иного метала, то обычно имеем в виде его плотность, то есть соотношение массы к занимаемому объёму.
Еще одним способом измерения «веса» металлов является их относительная атомная масса. Самыми тяжелыми металлами по относительной атомной массе являются плутоний и уран.
Если вы хотите узнать, какой металл самый тяжелый, если рассматривать его плотность, то мы рады вам помочь. Вот топ-10 самых тяжелых металлов на Земле с указанием их плотности на кубический см.
10. Тантал — 16,67 г/см³

Десятую строчку в рейтинге занимает синевато-серый, очень твердый металл со сверхвысокой температурой плавления. Несмотря на свою твердость он пластичен, как золото.
Тантал является важным компонентом во многих современных технологиях. В частности, он используется для производства конденсаторов, которые применяются в компьютерной технике и мобильных телефонах.
9. Уран — 19,05 г/см³

Это самый тяжелый элемент на Земле, если учитывать его атомную массу — 238,0289 г/моль. В чистом виде уран представляет собой серебристо-коричневый тяжелый металл, который почти вдвое плотнее свинца.
Как и плутоний, уран служит необходимым компонентом для создания ядерного оружия.
8. Вольфрам — 19,29 г/см³

Считается одним из самых плотных элементов в мире. В дополнение к своим исключительным свойствам (высокая теплопроводность и электропроводность, очень высокая стойкость к воздействию кислот и истиранию) вольфрам также отличается тремя уникальными свойствами:
- После углерода он имеет самую высокую температуру плавления — плюс 3422 ° C. А его температура кипения — плюс 5555 ° C, эта температура примерно сопоставима с температурой поверхности Солнца.
- Сопровождает оловянные руды, однако препятствует выплавке олова, переводя его в пену шлаков. За это и получил свое название, которое в переводе с немецкого означает «волчьи сливки».
- Вольфрам имеет самый низкий коэффициент линейного расширения при нагревании из всех металлов.
7. Золото — 19,29 г/см³

С давних времен люди покупают, продают и даже убивают за этот драгоценный металл. Да что люди, целые страны занимаются скупкой золота. Лидером государств с самыми крупными запасами золота на данный момент является Америка. И вряд ли наступит пора, когда в золоте не будет нужды.
Говорят, что деньги не растут на деревьях, но золото — растет! Небольшое количество золота можно найти в листьях эвкалипта, если тот находится на золотоносной почве.
6. Плутоний — 19,80 г/см³
Шестой самый тяжелый металл в мире — один из самых нужных компонентов для ядерных держав мира. А еще он — настоящий хамелеон в мире элементов. Плутоний демонстрирует красочное состояние окисления в водных растворах, при этом их цвет варьируется от светло-фиолетового и шоколадного до светло-оранжевого и зеленого. Цвет зависит от степени окисления плутония и солей кислот.
5. Нептуний — 20,47 г/см³

Этот металл с серебристым блеском, названный в честь планеты Нептун, был открыт химиком Эдвином Макмилланом и геохимиком Филиппом Абельсоном в 1940 году. Он используется для получения шестого номера в нашем списке, плутония.
4. Рений — 21,01 г/см³

Слово «Рений» происходит от латинского Rhenus, что означает «Рейн». Нетрудно догадаться, что этот металл был обнаружен в Германии. Честь его открытия принадлежит немецким химикам Иде и Вальтеру Ноддакам. Это последний из открытых элементов, у которого есть стабильный изотоп.
Из-за очень высокой температуры плавления рений (в виде сплавов с молибденом, вольфрамом и другими металлами) применяется для создания компонентов ракетной техники и авиации.
3. Платина — 21,40 г/см³

Один из самых драгоценных металлов в этом списке (кроме Осмия и Калифорния-252) используется в самых разных областях — от ювелирного дела до химической промышленности и космической техники. В России лидером по добыче платинового металла является ГМК «Норильский никель». В год в стране добывается около 25 тонн платины.
2. Осмий — 22,61 г/см³

Хрупкий и при этом крайне твердый металл редко используется в чистом виде. В основном его смешивают с другими плотными металлами, такими как платина, для создания очень сложного и дорогого хирургического оборудования.
Название «осмий» происходит от древнегреческого слова «запах». При растворении щелочного сплава осмиридия в жидкости появляется резкое амбре, похожее на запах хлора или подгнившей редьки.
И осмий и иридий (первое место рейтинга) весят примерно в два раза больше свинца (11,34 г/см³).
1. Иридий — 22,65 г/см³ – самый тяжелый металл

Этот металл с полным правом может претендовать на звание элемента с наибольшей плотностью. Однако споры о том, какой же металл тяжелее — иридий или осмий, все-таки ведутся. А все дело в том, что любая примесь может снизить плотность этих металлов, а их получение в чистом виде — очень тяжелая задача.
Теоретическая расчетная плотность иридия составляет 22,65 г/см³. Он почти втрое тяжелее, чем железо (7,8 г/см³). И почти вдвое тяжелее, чем самый тяжелый жидкий металл — ртуть (13,6 г/см³).

Как и осмий, иридий был открыт английским химиком Смитсоном Теннантом в начале 19 века. Любопытно, что Теннант нашел иридий вовсе не целенаправленно, а случайно. Он был обнаружен в примеси, оставшейся после растворения платины.
Иридий в основном используется в качестве отвердителя платиновых сплавов для оборудования, которое должно выдерживать высокие температуры. Он перерабатывается из платиновой руды и является побочным продуктом при добыче никеля.

Название «иридий» переводится с древнегреческого как «радуга». Это объясняется наличием в металле солей разнообразной окраски.
Самый тяжелый металл в периодической таблице Менделеева очень редко встречается в земных веществах. Поэтому его высокая концентрация в образцах породы — маркер их метеоритного происхождения. За год во всем мире добывают около 10 тысяч килограмм иридия. Крупнейший его поставщик — Южная Африка.
РТУТЬ — «кровь дракона» в лампах и реакторах
Удивительный жидкий металл, который так любили алхимики и называли его «кровь дракона», «меркурий», живое или жидкое серебро. Может, не так неправы были алхимики, когда стремилась превратить «живое серебро» в золото. Ведь в таблице Менделеева элементы ртуть и золото стоят рядом. Их атомные структуры различаются всего на один электрон.
Философский камень в пиаре ртути
История ртути неразрывно связана с развитием алхимии. Ученые упорно искали «философский камень», способный превращать любой металл в золото. В этих исследованиях они истратили тонны ртути. Философского камня не нашли, но очень продвинули вперед минералогию, химию и многие смежные науки.

Познавательно: Торричелли, ученик Галилея, изобрел ртутный барометр. Прибор настолько точен, что им до сих пор оборудуют метеостанции, по нему проверяют работу других барометров.
Свойства
Ртуть — удивительный элемент. Он относится к металлам, но при нормальных условиях представляет собой тяжелую жидкость.
«Живое серебро» — металл малоактивный, в реакции с растворами кислот не вступает, но с царской водкой реагирует, как и с азотной и серной кислотами.
Характеристики ртути вызывают удивление:
При взаимодействии ртути с металлами жидкий металл образует двухъядерные катионы (Hg22+). Это редчайшее для металлов свойство.
Этот легкоплавкий металл при замораживании всего до 39°С затвердевает. Из него можно даже сковать колечко, но носить его не получится — на пальце металл «растает».
Свойства атома Название, символ, номер Ртуть / Hydrargyrum (Hg), 80 Атомная масса
(молярная масса)200,592(3)[1] а. е. м. (г/моль) Электронная конфигурация [Xe] 4f14 5d10 6s2 Радиус атома 157 пм Химические свойства Ковалентный радиус 149 пм Радиус иона (+2e) 110 (+1e) 127 пм Электроотрицательность 2,00 (шкала Полинга) Электродный потенциал Hg←Hg2+ 0,854 В Степени окисления +2, +1 Энергия ионизации
(первый электрон)1 006,0 (10,43) кДж/моль (эВ) Термодинамические свойства простого вещества Плотность (при н. у.) 13,546 (20 °C) г/см³ Температура плавления 234,32 K (-38,83 °C)[2] Температура кипения 629,88 K (356,73 °C)[2] Уд. теплота плавления 2,295 кДж/моль Уд. теплота испарения 58,5 кДж/моль Молярная теплоёмкость 27,98[3] Дж/(K·моль) Молярный объём 14,81 см³/моль Кристаллическая решётка простого вещества Структура решётки ромбоэдрическая Параметры решётки ahex=3,464 сhex=6,708 Å Отношение c/a 1,94 Температура Дебая 100,00 K Прочие характеристики Теплопроводность (300 K) 8,3 Вт/(м·К) Номер CAS 7439-97-6 Металл имеет высокую плотность — 13,5 г/см3. Ведро, с налитой в него ртутью, не под силу поднять человеку — настолько оно тяжелое.

Плотность ртути при нормальных условиях — 13 546 кг/м3, при других температурах — в таблице ниже:
Температура в °С Плотность (ρ), 103 кг/м3 Температура в °С Плотность (ρ), 103 кг/м3 13,5950 50 13,4725 5 13,5827 55 13,4601 10 13,5704 60 13,4480 15 13,5580 65 13,4358 20 13,5457 70 13,4237 25 13,5335 75 13,4116 30 13,5212 80 13,3995 35 13,5090 90 13,3753 40 13,4967 100 13,3514 45 13,4845 300 12,875 Месторождения
Уникальное, старейшее и крупнейшее в мире месторождение ртутных руд находится в Испании, в местности Альмаден. Добычу жидкого серебра там вели еще до новой эры.

Кроме этого, запасами ртути обладают:
- Дагестан;
- Словения;
- Армения;
- Киргизия;
- Чукотка.
Самородная ртуть происхождением из киноварных руд.
Рассказ И. Ефремова «Озеро горных духов» получил неожиданное продолжение. В 2018 году на Аляске, под вечной мерзлотой обнаружили огромное озеро ртути. Ее там больше, чем общих запасов жидкого металла на планете. Пока мерзлота держит металл, опасности нет. Стоит растаять льдам — «живое смертоносное серебро» попадет в океан. Это будет глобальная экологическая катастрофа, а возможно, и конец жизни на Земле.
Применение
Ртуть широко применяется в разных сферах жизни:
- В сельском хозяйстве (как гербицид, для протравки семян).
- В медицине (лекарственные препараты).
- Как катализатор в изготовлении уксусной кислоты.
- Для изготовления приборов (термометры, полярографы, барометры, вакуумные насосы).
- Люминесцентные лампы, выпрямители.
- В качестве пигмента.
- «Гремучая ртуть» применяется в качестве детонатора.
- В атомно-водородной энергетике, чтобы разделить воду на водород и кислород.
В первых реакторах на БН (быстрых нейтронах) теплоносителем была ртуть.
Познавательно: в прошлом веке ртуть использовали в манометрах и барометрах. Поэтому долгое время давление измеряли в миллиметрах ртутного столба.
Польза «крови дракона» несомненна в разных отраслях промышленности. Однако она перечеркивается высокой токсичностью металла и его соединений.

Жидкое серебро в нашем доме
Почти в каждом доме есть ртутный градусник, и разбить его очень просто. Ртуть окажется на полу, это создаст опасность для здоровья.
Как правильно собрать шарики ртути:
- Ртуть легко «прилипает» к оловянной фольге.
- Если в доме есть азотная кислота — смочите в ней медную проволочку, и собирайте ртутные шарики в емкость (лучше стеклянную).
- Попытайтесь собрать шарики шприцем без иглы.
- Мелкие частички можно собирать скотчем.
- Обработайте место разлива раствором марганцовки или хлорной извести.
Нельзя собирать разлившийся металл веником или пылесосом.
Познавательно: если вы купили термометр, а в нем красная жидкость — не думайте, что это легендарная красная ртуть. Это просто спиртовой, а не ртутный термометр.
Почем «кровь дракона»
Цена металлической ртути от 5 тыс. рублей за килограмм.
Соединения ртути имеют разную цену в зависимости от чистоты. ЧДА (чистый для анализа) — самые дорогие.

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Источник https://chem.ru/rtut.html
Источник https://basetop.ru/samyiy-tyazhelyiy-metall-v-mire-top-10/
Источник https://themineral.ru/metally/rtut